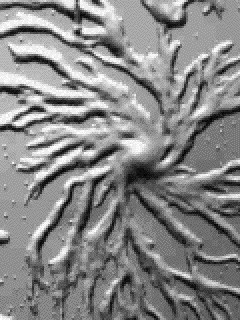
aus: Peter v. Sengbusch: Molekular- und Zellbiologie - Springer - Verlag, Heidelberg 1979
Update und Hypertextverknüpfungen zu Botanik online 5 / 2001
Beiträge aus: DictyBase: An Online Informatics Resource for Dictyostelium - mit AVI - Dateien
Dictyostelium ist ein zellulärer Schleimpilz, der als einzellige Amöbe, als Zellaggregat und schließlich in Form eines vielzelligen Fruchtkörpers vorkommen kann. Entdeckt wurde die erste Art 1869 von BREFELD. Dictyostelium discoideum, die Art, mit der heute die meisten Experimente durchgeführt werden, wurde 1935 von RAPER (a new species of slime mould from decaying forest leaves) beschrieben. Während der Wachstums- und Vermehrungsphase findet man nur frei lebende, einzellige Amöben, die sich von Bakterien ernähren. Diese Phase endet bei Nahrungsmangel.
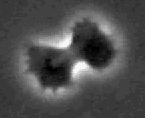
Amöboide Bewegung und Teilungsstadium - AVI-File Dreidimensionale Bildrekunstruktion einer chemotaktisch ausgelösten amöboiden Bewegung © DictyBase: An Online Informatics Resource for Dictyostelium |
Nach einer Differenzierungsphase, die auch Interphase genannt wird und ca. 8 Std. dauert, beginnen die Amöben zu aggregieren. Sie wandem auf ein Aggregationszentrum zu und bilden einen vielzelligen Fruchtkörper, der bei Dictyostelium discoideum aus der Basalplatte, dem Stiel und dem Sporenköpfchen besteht.
 Aufrichtung des Fruchtkörpers - AVI-File Aufrichtung des Fruchtkörpers - AVI-File
© DictyBase: An Online Informatics Resource for Dictyostelium |
Die Zellen des Stiels und der Basalplatte sind stark vakuolisiert und sterben im fertigen Sporenträger ab. Die länglichen Sporen sind gegen Hitze und Austrocknung resistent und in der Lage, bei Keimung einen neuen Entwicklungszyklus einzuleiten. Beide Zelltypen sind im Gegensatz zu den Zellen der vorausgehenden Entwicklungsstadien von einer Cellulosewand umgeben. Die Aggregation erfolgt in geordneter Weise (self assembly). Die Amöben sammeln sich zu Strängen, in denen sie auf ein Zentrum zustreben.
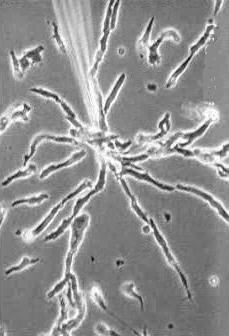 | Chemotaxis - mpg-File
Aggregation von Dictyostelium discoideum Amöben. Bewegung auf den chemotaktischen Reiz zu (cAMP aus der Pipette ins Medium zugegeben). Ziffern im oberen Bildteil: Minuten und sekunden. Aufnahmen: G. GERISCH, Max-Planck-Institut fÜr Biochemie, Martinsried, Germany. Details der Chemotaxis - mpg-file
Zellbewegungen während der Aggragation - mpg-file
Strang- und Aggregatbildung - AVI-file
Kulmination - AVI-file
© DictyBase: An Online Informatics Resource for Dictyostelium |
Ein Strang besteht aus mehreren Reihen parallel nebeneinander herlaufender Amöben. In Wanderrichtung orientieren sich die Individuen Kopf an Schwanz, womit erstmals eine Längsachse der Zellen erkennbar wird. Kleine Aggregationszentren verschwinden und integrieren sich in die größeren. Bei genauerer Betrachtung erkennt man, daß die Sammelbewegung wellenförmig abläuft.
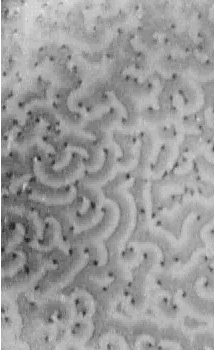 |
AVI-File: Zentrum einer Welle aggregierender Dictyostelium discoideum Zellen.
AVI-File: Das Aggregationszentrum ein Schrittmacher
© DictyBase: An Online Informatics Resource for Dictyostelium |
Dictyostelium hat sich als ein geeignetes Versuchsobjekt zum Studium von Entwicklungsprozessen bewährt. Uns interessieren hierzu vor allem die Fragen:
1947 fand BONNER, daß hungernde Amöben eine chemotaktisch wirkende Substanz ausscheiden, die 1967 von KONIJN, van der MEENE, J. T. BONNER und BARKELEY (Princeton University) als cAMP identifiziert wurde. Die nah verwandte Art Polysphondylium violaceum arbeitet mit einem Oligopeptid als chemotaktischem Reizstoff. Frei lebende, "satte" Amöben (von Dictyostelium) reagieren nur schwach chemotaktisch auf cAMP. Während der Interphase erwerben sie folgende Eigenschaften:
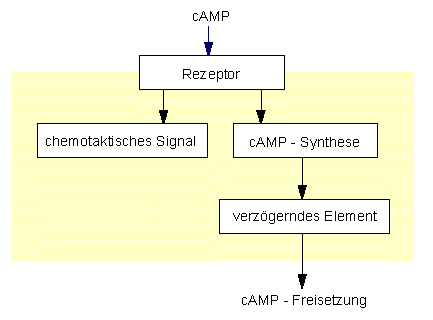
Eine Dictyostelium-Zelle als Relais: Verstärkung des cAMP-Signals auf Eigensynthese und Freisetzung (nach GERISCH et al., 1975)
Eine Aggregation erfolgt nur in Populationen mit einer minimalen Populationsdichte von ca. 400 Zellen / mm2. Die Zellen können noch cAMP-Gradienten wahrnehmen, die eine Steigung von delta c / c = 0,01 über die Zellänge haben. Zu flache Gradienten können nicht mehr wahrgenommen werden, wodurch der Einflußbereich der Chemotaxis auf einen Radius von maximal 1 mm begrenzt wird. Das Aggregationsverhalten beruht einmal auf Chemotaxis und zum anderen auf einer Signalverstärkung. Der Verstärkereffekt output / input erreicht den Faktor > 10. Die mittleren Abstände der Zellen voneinander dürfen 50 µm nicht überschreiten.
Die cAMP-Freisetzung in Form von Stößen läßt sich am eindrucksvollsten in einer Zellsuspension synchronisierter Zellen beobachten. Durch die Freisetzung ändert sich nämlich das Aggregationsverhalten und damit die Lichtstreuung dieser Kulturen. Somit läßt sich die Ausbildung der Impulse und die Periodendauer relativ leicht bestimmen. Durch Zugabe von cAMP kann die Phase verschoben werden (GERISCH und HESS, 1974). Es gibt Mutanten mit einer vom Wildtyp unterschiedlichen Periodendauer. Offenbar ist dort die Aktivität von Enzymen, welche die cAMP-Konzentration kontrollieren, anders als im Wildtyp.
Aggregationsfähige Zellen hydrolysieren cAMP mit Hilfe einer membrangebundenen Phosphodiesterase. MALCHOW und GERISCH (Biozentrum der Universität Basel. 1974) zeigten, daß cAMP-Rezeptoraktivität (Signalwandlung) und Phosphodiesteraseaktivität auf verschiedenen Molekülen lokalisiert sind. Die cAMP Ausschüttung erfolgt mit einer Zeitverzögerung von 15 Sek. nach der Erkennung des Signals.
Wie sieht die Übersetzung zwischen Signalwahrnehmung an verschiedenen Orten der Zelloberfläche und gerichteter Ausbildung von Pseudopodien aus?
Folgende Prozesse lassen sich feststellen und auseinanderhalten:
Diese Aussagen sind in der folgenden Abbildung modellmäßig dargestellt.
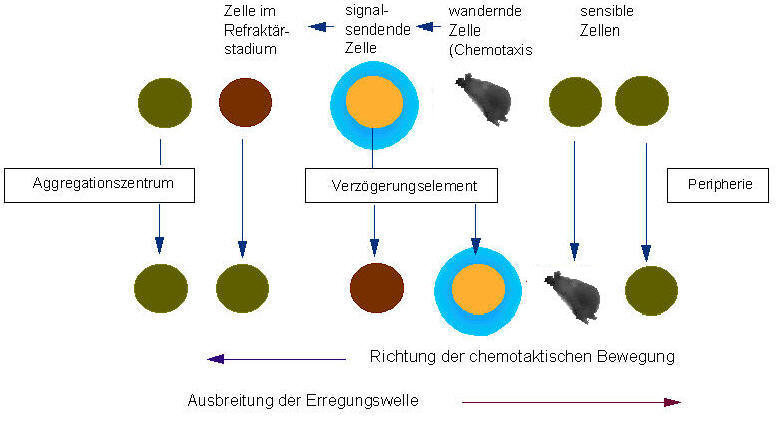
Vereinfachtes Diagramm der Kommunikation aggregierender Dictyostelium discoideum - Zellen mittels eines sich durch Diffusion verteilenden Transmitters. Vom Aggregationszentrum aus werden periodische Signale freigesetzt, die sich in Form konzentrischer Ringe ausbreiten (nach GERISCH et al., 1975)
Zum Erfassen räumlicher Gradienten stehen einer Zelle prinzipiell zwei Wege offen:
Vier Modellvorstellungen sind denkbar.
Die Modelle 1 und 2 scheiden aus, weil sie nicht alle bekannten experimentellen Daten berücksichtigen. 3 und 4 sind gleich wahrscheinlich. Das Modell 4 kombiniert die Eigenschaften von 1 und 3.
Zusammenfassend lassen sich die bisher vorgelegten Ergebnisse von Beobachtungen und Experimenten zu einem Modell vereinen. Ergänzend sei hinzugefügt, daß nicht nur cAMP, sondern auch cGMP an der Regulation mitwirkt. Die bei der Aggregation von Dictyostelium ablaufenden und hier beschriebenen Vorgänge ähneln in mancherlei Hinsicht den Vorgängen an Synapsen. Dort wird ein kleines Molekül, ein Neurotransmitter (z.B. Acetylcholin) freigesetzt und von den Acetylcholinrezeptoren der benachbarten Zelle erkannt. Es folgt ein kurzzeitiger Ioneneinstrom in die Zelle. Die ebenfalls anwesende Acetylcholinesterase sorgt dafür, daß der Impuls auf einen kurzen Zeitraum beschränkt bleibt.
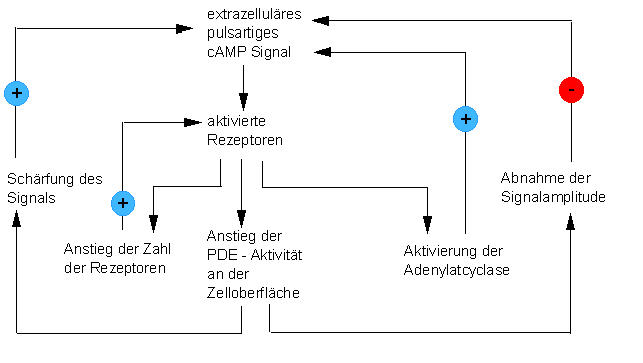
Schaltplan des Netzwerkes, durch die die Differenzierung von Dictyostelium discoideum - Zellen gesteuert wird (nach ROOS et al., 1977)
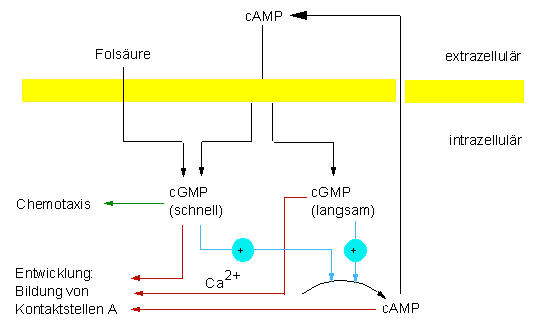
Nachgewiesene (schwarze Linien) und postulierte (farbige Linien) Verknüpfungen des Signalsystems der Dictyostelium discoideum - Zellen (nach GERISCH et al., 1977)
Auch zum beschriebenen Verstärkermechanismus finden wir im Nervensystem ein Analogon. Eine Erregung wird entlang eines Axons elektrochemisch weitergeleitet, wobei ein Selbstverstärker hinter den anderen geschaltet ist. Ähnlich bei Dictyostelium: Es gibt keinen Gradienten, der über weite Entfernung hin angelegt ist, sondern eine Nachrichtenübertragung von Zelle zu Zelle, wobei Informationsverluste an jeder Relaisstation wieder wettgemacht werden. Und schließlich wäre die Refraktärperiode zu nennen, in die jede Zelle nach Signalweitergabe eintritt, denn sie ist mit dafür verantwortlich, daß die Nachricht gerichtet weitergeleitet wird.
Während der Aggregationsphase bilden sich zwischen den benachbart liegenden Zellen Kontakte aus. Daran sind spezifische Moleküle beteiligt. BEUG et al. (Friedrich Miescher Laboratorium der Max-Planck-Gesellschaft, Tübingen, 1973) haben den Zeitpunkt ihrer Entstehung und ihre Verteilung bestimmt. Aggregierende Zellen sind langgestreckt. Sie zeigen eine Preferenz für End-zu-End-Aggregation ("Kopf-Schwanz"), eine Aneinanderlagerung erfolgt aber auch Seite an Seite. Hierdurch entsteht die eingangs erwähnte Ausbildung von Strängen.
Auf den Zelloberflächen sind zwei voneinander verschiedene, antigene "Kontaktmoleküle" (A und B) identifiziert worden. Sie wurden unter Einsatz von anti-A und anti-B lokalisiert. Zum Test wurden jedoch nicht die intakten Antikörper verwendet, sondern monovalente Fab-Fragmente, da die divalenten Antikörper ein Capping hervorrufen. Hierbei wird das aggregierte Material aber nicht phagozytiert (wie bei Lymphozyten u.a.), sondern abgestoßen. Zell-Zell-Interaktionen werden durch spezifische Fab-Fragmente vollständig unterbunden. Fab-Fragmente, die spezifisch gegen aggregationskompetente Zellen gerichtet sind, hemmen die End-zu-End-Aggregation. Fab-Fragmente, die gegen Zellen in der Wachstumsphase gerichtet sind, reagieren mit der ganzen Zelloberfläche und verhindern damit eine Seite-an-Seite-Aneinanderlagerung. Es gibt also zwei serologisch voneinander unterscheidbare Klassen von Kontaktstellen (Kontaktmolekiilen):
A: End-zu-End-Aggregation,
B: Seite-an-Seite-Anlagerung.
B ist immer vorhanden, A wird synchron mit der Kompetenz zur Aggregation erworben. Die Kontaktstellen B werden durch EDTA inhibiert, das auf A keinen Einfluß hat. Bindung anderer, vorzugsweise gegen Kohlenhydrat gerichteter Fab-Fragmente hat keinen Einfluß auf das Aggregationsvermögen.
Eine Dictyostelium-Zelle hat einen mittleren Durchmesser von 11 µm. Pro µm2 werden maximal 68 x 102 Fab-Moleküle verschiedener Spezifität gebunden (Dimension des Fab-Moleküls: 35 x 35 x 50 Angström). Von dem anti-Kohlenhydrat-Fab bindet eine Zelle 2,5 x 106 Moleküle, von den spezifischen anti-A-Fab-Molekülen jedoch nur 3 x l05 Moleküle, was ungefähr 8 x 102 Molekülen / µm2 entspricht. Daraus geht hervor, daß die Spezifität der Aggregation auf nur wenigen Oberflächenrnolekülen beruht. Unter Bedingungen maximaler Fab-Bindung werden 14 % der Zelloberfläche bedeckt. Weniger als 2 % der Fläche wird von Fab-Fragmenten abgedeckt, die spezifisch gegen Kontaktstelle A gerichtet sind.
Wenn die Zellen der zellulären Schleimpilze Aggregationskompetenz erwerben, erscheinen an der Zelloberfläche spezifische Lektine. Auf der Diciyostelium-Oberfläche wurden die Lektine Discoidin 1 und Discoidin II nachgewiesen, auf der von Polysphondylium pallidum das Pallidin (REITHERMANN et al., University of Califomia, San Diego, 1975). Es kann als wahrscheinlich angenommen werden, daß diese kohlenhydratbindenden Proteine an der interzellulären Adhäsion der Zellen beteiligt sind. Die drei genannten Lektine unterscheiden sich voneinander in bezug auf ihre Affinität zu bestimmten Zuckerresten. Die artspezifischen Unterschiede mögen als ein Hinweis darauf zu verstehen sein, daß Zellen verschiedener Arten keine gemeinsamen Aggregate bilden.
Wir haben schon eine ganze Reihe von Unterschieden zwischen freilebenden und aggregationskompetenten Amöben kennengelernt. Während der Differenzierungsphase erscheinen neue Aktivitäten, so u.a. die
Adenylatcyclase, die membrangebundene Phosphodiesterase, dann das Protein der Kontaktstelle A (Connexin A) und das Discoidin I und II. Schon die wenigen Beispiele weisen darauf hin, daß bei der Umstellung vom Ein- zum Vielzeller zahlreiche neue Genaktivitäten benötigt werden, womit wir uns die Frage vorlegen können, ob es einen Schalter gibt, durch den alternativ das eine oder das andere Programm aktiviert wird, oder ob bei der Umstellung nach und nach neuartige Aktivitäten auftreten, wobei man sich vorstellen könnte, daß die Umstellung kaskadenartig erfolgt. Hierzu finden im Phagen lambda ein anschauliches Modell: Erst wenn sich das Genprodukt des Gens N angereichert hat, wird Gen Q aktiviert, und erst, wenn das geschehen ist, können jene Gene aktiviert werden, deren Genprodukte Kopf und Schwanzstrukturen ausbilden.
Bei Dictyostelium könnten wir uns folgendes vorstellen:
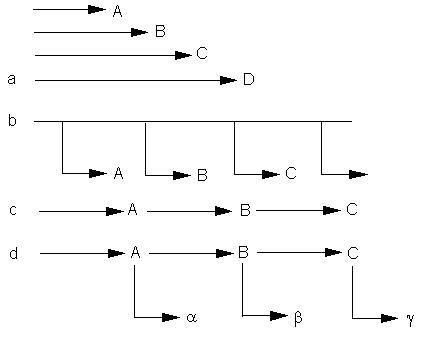
a - d: Modelle zur Erklärung aufeinanderfolgender Aktivierung (Synthese) verschiedener Enzyme während der Entwicklung. a. Die Enzymsynthesen werden unabhängig voneinander initiiert. b. Ein Zeitgeber bestimmt, in welcher Reihenfolge Enzyme gebildet werden. c. Die Synthese eines Enzyms ist von der vorangegangenen Synthese eines anderen abhängig. d. Kombinationssequenz (Zeitgeber und Abhängigkeit) (nach ASHWORTH, 1976)
Wir werden sehen, daß in Wirklichkeit ein Kompromiß zwischen beiden Alternativen realisiert ist. Es gibt mehrere experimentelle Zugänge, um die Ablösung eines genetischen Programms durch ein anderes zu verfolgen. Man kann die Details der Umstellung analysieren, wenn man sich darauf konzentriert, zu untersuchen, wann welches Enzym erscheint. Hierüber liegt eine Reihe von Untersuchungen vor. Genannt seien vor allem die Arbeiten von LOOMIS et al. (University of Califomia, San Diego, 1975, 1976). Diese Daten sind allein deshalb von besonderem Interesse, weil sie nicht nur am Wildtyp, sondem auch an einigen Mutanten mit Entwicklungsdefekten gewonnen worden sind.

Kombinationssequenz. Aufeinanderfolgendes Erscheinen von Enzymen bei der Aggregation von Dictyostelium discoideum. Die aufeinanderfolgenden Schritte (A > B ..... > H) konnten durch das Vorhandensein von Mutanten (VA 5, DA 2;....MIN 2) als voneinander unabhängige Ereignisse ermittelt werden. Durch Mutation an einer bestimmten Stelle werden alle darauffolgenden Reaktionen unterbunden. Die Ziffern stehen für die folgenden Enzyme: 1. Alanin-Transaminase, 2. Leucin-Aminopeptidase, 3. N-Acetylglucosaminidase, 4. alpha-Mannosidase, 5. Trehalosephosphat-Synthetase, 6. Threonindeaminase, 7. Tyrosintransaminase, 8. UDPG-Pyrophosphorylase, 9. Glykogen-Phosphorylase, 10. Alkalische Phosphatase, 11. beta-Glucosidase (nach LOOMIS et al., 1976)
Bei Dictyostelium sieht es so aus, als sei die Synthese eines bestimmten Proteins für den Fortgang des Differenzierungsprozesses entbehrlich. Es ist also nicht so wie beim Phagen lambda, daß die Transkription (und Translation) eines Gens vom Vollzug dieser Prozesse an einem anderen Gen abhängt. Die Bildung einer Reihe von Enzymen kann unterbleiben, ohne daß die Entwicklung zum Stehen kommt. Der Verlust eines Genproduktes kann jedoch die Ausbildung eines nachfolgenden Differenzierungsstadiums verhindern. UDPG-Phosphorylase z.B. wird während des Zeitraums von 12-20 Std. nach Einsetzen der Differenzierung gebildet und akkumuliert, wird aber erst zum Zeitpunkt 18-20 Std. wirklich benötigt. Dann nämlich differenzieren sich die Zellen in Stielzellen und Sporen. Bei einer UDPG-Phosphorylase defizienten Mutante unterbleibt dieser Schritt. Auch Migration und Culmination können erst dann initiiert werden, wenn sich bestimmte Genprodukte angereichert haben. Es sieht so aus, als würden für den gesamten Differenzierungsprozeß über 200 verschiedene Gene benötigt.
Dissoziiert man Aggregate und bietet den Zellen genügend Bakterien an, so können sie zum Amöbenstadium zurückkehren. Die Synthese der UDPG-Pyrophosphorylase wird eingestellt. ALTON und LODISH (Massachusetts Institute of Technology, 1977) haben die eben aufgezeigten Probleme auf der Transkriptions- und Translationsebene bearbeitet. Die DNS von Dictyostelium enthält 4,5 x 107 Basenpaare, das ist dreimal mehr als bei der Hefe und siebenmal mehr als bei Escherichia coli. Die Transkriptionsprodukte tragen, wie bei anderen Eukaryonten auch, am 5'-Ende eine Kappe und am 3'-Ende eine Poly (A) - Sequenz. In der vegetativen Phase kommt mRNS in folgenden Häufigkeiten vor: ca. 30 Sequenzen in 1000 Kopien pro Zelle, 500 in 100 Kopien und 3000 Sequenzen in 10-20 Kopien. Zu Beginn der Aggregationsphase ändert sich das Bild, dann treten auf: 30 Sequenzen in 300-400 Kopien pro Zelle, 700 Sequenzen in 20 30 Kopien und 10.000 Kopien in ca. zwei Kopien pro Zelle. Die Gesamtmenge sowie das Verhältnis von mRNS zu Gesamt-Zell-RNS bleibt während aller Phasen gleich. Während der Wachstums- und / oder der Aggregationsphase werden an die 400 Proteine gebildet, die als distinkte Einheiten nach der O'Farrell-Methode identifizierbar sind; Aktin ist das mit Abstand häufigste davon. Die Synthese der meisten von ihnen setzt sich auch während der weiteren Differenzierungsphasen fort. Bei etwa 100 ändern sich die relativen Syntheseraten. Während des Übergangs von der Wachstums- zur Interphase wird lediglich die Synthese von acht Proteinen eingestellt. Bis zum Ende der Aggregationsphase sind keine weiteren gravierenden Veränderungen feststellbar, doch dann erscheinen 40 neue Proteine, und die Syntheserate von zehn der vorhergebildeten wird reduziert. Dann kommt wieder eine Phase, in der wenig passiert, und schließlich die Culminationsphase, die ebenfalls mit Veränderungen relativer Syntheseraten einhergeht. Um dieses Muster verstehen zu können, wurde RNS aus verschiedenen Entwicklungsstadien isoliert und in einem in vitro-System (Weizenkeimsystem) translatiert. Daraus ist zu schließen, daß mRNS erst dann gebildet wird, wenn sie auch wirklich gebraucht wird, und das wiederum bedeutet, daß die Regulation der Proteinbiosynthese während der Entwicklung und Differenziemng von Dictyostelium zum großen Teil wenigstens auf der Ebene der Bildung und Zerstörung von mRNS erfolgt.
ALTON, T. H., LODISH, H. F.: Developmental changes in messenger RNAs and protein synthesis in Dictyo-stelium discoideum. Dev. Biol. 60, 180 (1977)
ASHWORTH, J. M.: Control of cell differentiation in the cellular slime mould Dictyostelium discoideurn. Biochem. Soc. Trans. 4, 33 (1976)
BEUG, H., KATZ, F. E, GERISCH, G.: Dynamics of antigenic membrane sites relating to cell aggregation in
Dictyostelium discoideum. J. Cell Biol. 56, 647 (1973)
BOZZARO, S., GERISCH, G.: Contact sites in aggregating cells of Polysphondylium pallidum. J. Mol. Biol. 120, 265 (1978)
BREFELD, O.: Dictyostelium mucoroides. Ein neuer Organismus aus der Verwandtschaft der Myxomyceten. Abh. Senckenb. Naturforsch. Ges. 7, 85 (1869)
GERISCH, G.: Periodische Signale steuern die Musterbildung in Zellverbänden. Naturwissenschaften 58,
430 (1971)
GERISCH, G.: Cyclic-AMP oscillation and signal transmission in aggregating Dictyostelium cells. In:
Dahlem Workshop on the molecular basis of circadian rhythms. HASTINGS, Y. W., SCHWEIGER, H.-G. (eds.). Berlin: Life Science Report 1 (1976)
GERISCH, G., MALCHOW, D.: Cyclic AMP receptors and the control of cell aggregation in Dictyostelium. Adv. Cyclic Nucleotide Res. 7, 49 (1976)
GERISCH, G., HÜLSER, D., MALCHOW, D., WICK, U.: Cell communication by periodic cyclic-AMP pulses. Philos. Trans. R. Soc. Lond. B 272, 181 (1975)
LOOMIS, W. F., WHITE, S., DIMOND, R. L.: A sequence of dependent stages in the development of Dictyostelium discoideum. Dev. Biol. 53, 171 (1976)
RAPER, K. B.: Dictyostelium discoideum, a new species of slime mold from decaying forest leaves. J. Agric. Res .50, 135 (1935)
ROOS, W., MALCHOW, D., GERISCH, G.: Adenyl cyclase and the control of cell differentiation in Dictyostelium discoideum. Cell Differ. 6, 229 (1977)
SHAFFER, B. M.: The acrasina. Adv. Morphogen. 2, 109 (1962)
|