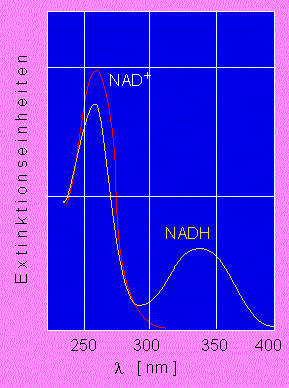
Optischer Test nach O. Warburg. Die reduzierte Form des NAD (gelbe Kuve) zeichnet sich durch eine Absorption bei lambda = 340 nm aus. Die oxydierte Form (rote Kurve) zeigt in dem Bereich keine Absorption. Die optische Dichte in dem Bereich (Werte auf der Ordinate) ist daher direkt proportional zur Menge reduzierten NADs in einer gegebenen Probe. Auf der Abszisse sind die Wellenlängen zwischen lambda 250 - 400 nm wiedergegeben.
Der bekannteste und häufigste Wasserstoffakzeptor ist das Nicotinamidadenindinukleotid (NAD):
NAD+ + 2e- + 2H+ < > NADH + H+
oder z.B.
NAD+ + R-CHOH-R' < > NADH + H+ + R-CO-R'
Eines der Protonen wird vom NAD+ direkt an den Nicotinamidring gebunden, das andere verbleibt in Lösung.
NAD+ ist ein Koenzym (eine prosthetische Gruppe); es wirkt nie alleine, sondern ausschließlich nach Bindung an ein Protein. NAD+-bindende Proteine (Enzyme) gehören in die Klasse der Dehydrogenasen. Alle katalysieren die gleiche chemische Reaktion (siehe oben), unterscheiden sich jedoch in bezug auf ihre Substratspezifität. So kennt man unter vielen anderen die Alkoholdehydrogenase, die Lactatdehydrogenase, Malatdehydrogenase, Glycerinaldehydphosphatdehydrogenase u.a.
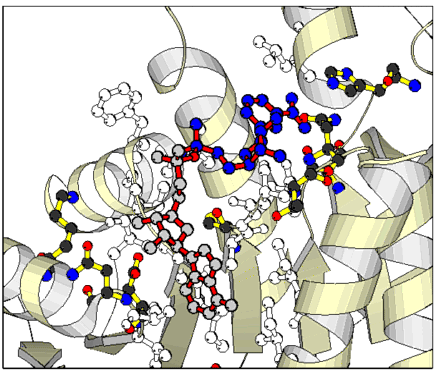
NAD - Lactatdehydrogenase (LDH) - Komplex. Das NAD (farbig dargestellt) wird in geknickter Konformation gebunden: Die LDH ist hier nur in Ausschnitten dargestellt. Die alpha - Helices sind durch Bänder gekennzeichnet, die beta - Faltblätter durch Pfeile. Aminosäureseitenketten, die mit dem NAD in direktem Kontakt stehen, sind in Umrissen wiedergegeben.
Ein Derivat des NAD+ ist das NADP+ (Nicotinamidadenindinukleotidphosphat). Dieses Koenzym ist für uns besonders deshalb so wichtig, weil es in der Photosynthese das NAD+ vertritt. Beide werden von den jeweiligen Enzymen nur über schwache Interaktionen gehalten. Beim Einpassen in eine Tasche an den Enzymoberflächen nehmen sie eine spezifische Konformation an.
Das delta G° der Reaktion
NADH + H+ < > NAD+ + 2H+ + 2e-
beträgt 14,8 kcal/mol (ca. = 62kJ/mol), der E'° -Wert -0,32. Bei der Reaktionsumkehr müssen die Vorzeichen vertauscht werden.
Andere Wasserstoffüberträger: Hierzu gehören die Flavine, die Chinone, die Porphyrine (Häm-Gruppen) und einige metallionenenthaltende Proteine.
Flavine: Das häufigste Flavin ist das Flavinadenindinukleotid (FAD), das neben einem Adeninrest Riboflavin (Vitamin B2) enthält.
Der Begriff Vitamin dürfte in einem Botaniklehrprogramm eigentlich gar nicht erscheinen, denn er stammt aus der Ernährungsphysiologie des Menschen und beschreibt eine Gruppe von Molekülen, zu deren Synthese der Mensch (und viele Tiere) nicht in der Lage ist und die er mit pflanzlicher Nahrung aufnehmen muß. Die meisten der Vitamine haben Koenzymcharakter. Da pflanzliche Zellen sie ganz normal synthetisieren, sollte man sie ganz einfach unter den Stoffklassen besprechen, denen sie aufgrund ihrer chemischen Struktur angehören. Der aktive Anteil im FAD ist ein Alloxazinring. Im Gegensatz zum NAD+ (oder NADP+) werden hier beide Protonen und beide Elektronen vom Ringsystem gebunden. Hinzu kommt, daß das FAD kovalent an Protein gebunden wird. Das gilt auch für das verwandte Flavinmononukleotid (FMN). Nach Bindung dieser Kofaktoren nehmen die Proteine eine gelbe Farbe an, sie werden daher als Flavoproteine bezeichnet. Korrekterweise sei auch noch vermerkt, daß es sich bei diesen Verbindungen nicht, wie ihr Name sagt, um Nukleotide handelt, denn der Alloxazinring hängt nicht an einem Zuckerrest (Ribose), sondern an einem Alkohol (Ribit, Ribitol). Flavine sind u.a. an den Dehydrogenasereaktionen der Atmungskette beteiligt.
Chinone: Sie wirken an Redoxreaktionen in Mitochondrien (Atmungskette) und Chloroplasten (Photosynthese) mit. Man unterscheidet zwischen den Ubichinonen und den Plastochinonen, die sich durch unterschiedliche Seitenkettenreste am Chinonring auszeichnen. Ein Ubichinon nimmt als "Koenzym Q" eine Schlüsselstellung als primärer Elektronenakzeptor im Photosystem II der Photosynthese ein.
Porphyrinringe/ Hämgruppen: Viele Metalle liegen in mehr als einem stabilen Oxydationszustand vor. Das bekannteste und auch für Zellen wichtigste Beispiel ist das Eisen, das als dreiwertiges Ferriion (FeIII) und als zweiwertiges Ferroion (FeII) vorkommt.
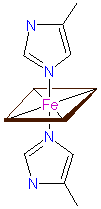
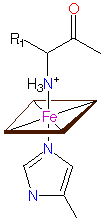
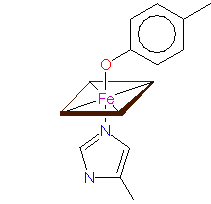
Liganden der Hämgruppe - Haem iron coordination - a.: im Cytochrom c, der Cytochrom Oxydase u.a., b.: im Cytochrom f, c.: in der Cytochrome cd1 Nitrit Reduktase © PROMISE
In der Hämgruppe (einem eisenhaltigen Porphyrinring) des Hämoglobins (und des Leghämoglobins) kommt nur FeII vor, das die Eigenschaft hat, Sauerstoff zu binden. In den Cytochromen kommt es zu Valenzwechseln. Cytochrome sind als Zwischenglieder sowohl bei der Atmungskette als auch bei der Photosynthese beteiligt; die einzelnen Typen unterscheiden sich in erster Linie durch ihren Proteinanteil voneinander. Das bekannteste und an der Photosynthese mitwirkende metallionentragende Protein ohne Hämgruppe ist das Ferredoxin.
|
|